Исследование таможенно-технического регулирования по борьбе с незаконным оборотом лекарственных средств в дальнем зарубежье
Квятковский Д.В.1, Завьялов Д.В.1
1 Российский экономический университет им. Г.В. Плеханова, ,
Скачать PDF | Загрузок: 22
Статья в журнале
Экономика, предпринимательство и право (РИНЦ, ВАК)
опубликовать статью | оформить подписку
Том 14, Номер 3 (Март 2024)
Эта статья проиндексирована РИНЦ, см. https://elibrary.ru/item.asp?id=63861847
Аннотация:
В данной статье были раскрыты особенности таможенно-технического регулирования оборота лекарственных (лечебных) средств в различных странах: США, Китае, странах Европейского Союза, иных зарубежных государствах. Были выделены отдельные особенности и элементы правового механизма борьбы с нелегальным и противоправным обращением отдельных медицинских и лекарственных средств. На основании анализа различных статистических показателей выявлены негативные моменты в распространенности контрафактных и фальсифицированных средств на рынке фармакологических препаратов. Данное публицистическое исследование вопросов борьбы с контрафактной, фальсифицированной продукцией в виде различных незаконно произведенных и выпущенных лекарственных препаратов, медикаментов представляет собой законченную работу, имеющую безусловную практическую и научную значимость для различных субъектов, занимающихся разработкой и внедрением мер и средств противодействия противоправному обороту лекарственных средств, а также ученых и специалистов в сфере таможенно-технического регулирования, государственного управления, фармакологии, правоведения. Также в статье проведены уточнения некоторых проблемных аспектов профилактики и регулирования мер борьбы с незаконным оборотом лекарственных препаратов в зарубежных странах и России на современном этапе, что определяет новизну постановки отдельных вопросов. Изучение современных тенденций развития правовых и организационно-технических средств предупреждения и пресечения незаконного обращения лекарственных препаратов позволяет приобрести публикации характер специального прикладного исследования.
Ключевые слова: техническое регулирование, законодательство, зарубежные страны, лекарственные препараты, фармакологический препарат, лечебное средство, США, Китай, Европейский Союз, нелегальное обращение
JEL-классификация: L65, L81, O33
ВВЕДЕНИЕ
Лекарственные препараты, их оборот в национальном, внешнеторговом и мировом масштабах, связанные с ними меры государственной политики в области таможенно-технического регулирования продажи, покупки, разработки, исследования, производства и распространения лечебных средств для лечения и профилактики, в значительной степени влияют на здоровье и качественное медицинское обслуживание населения каждой страны.
Индустрия производства и распространения фармакологических препаратов довольно сложна с точки зрения развития патентованного и лицензионного законодательства, средств контрольно-надзорной и ограничительной деятельности органов управления в сфере таможенно-технического регулирования рынка лекарственных препаратов и иных средств лечения и профилактики.
Поэтому в России и отдельных зарубежных странах (США, Китае, государствах Европейского Союза (далее по тексту – ЕС или Евросоюз), Африки и Азии, других территориальных образованиях) на важном месте в сфере социально-экономической политики находится разработка различных стандартов, норм, санитарных правил, положений, касающихся защиты от нелегального обращения некачественных и опасных для здоровья лекарственных препаратов и лечебных средств.
Фармацевтика как отрасль производства и распространения на национальных и международных рынках лекарственных и фармакологических препаратов, лечебных средств является важнейшим элементом формирования системы качественного обеспечения медицинскими услугами населения России и зарубежных стран, и в целом влияет на все отрасли здравоохранения, благополучия граждан и демографии.
При этом важность разработки и совершенствования технических регламентов, таможенного законодательства, касающихся оборота лекарственных препаратов, подтверждается современными тенденциями расширения сферы непатентованных, некачественных, фальсифицированных, контрафактных средств лечения и профилактики, различных «дженериков» как нового тренда на рынке фармакологических препаратов.
Целью данной статьи стал анализ мер и правовых средств борьбы с нелегальным обращением различных медицинских средств лечения и профилактики заболеваний в иностранных странах «дальнего зарубежья».
Вопросы качественного и количественного развития сферы фармакологии, инструментов таможенно-технической политики зарубежных стран и России в отношении пресечения и ограничения нелегального обращения лекарственных препаратов и лечебных средств являются предметом изучения как российских научных деятелей и практиков [3,5,6,8,11,12,13], так и зарубежных ученых: правоведов, специалистов фармакологии, экономистов, специалистов иного профиля [14-18].
В частности, в работах иностранных специалистов ставятся вопросы некачественности лечения, оказанного в исправительных учреждениях США и связанного с непринятием мер проверки поддельных и фальсифицированных лекарственных препаратов, применяемых для оказания медикаментозной помощи осужденным [14].
В публикациях поднимаются вопросы противоправности реализации лечебных средств в виде каннабиса подросткам [18], анализа деятельности FDA в сфере контроля за оборотом лекарственных средств [17]; необходимости совершенствования правового регулирования оборота рецептурных лекарств в Чили и Мексике [15; 16].
Российские ученые ставят вопросы обоснованности отдельных мер проведения таможенно-технической политики России в отношении иностранных лекарственных средств [11;12], важности ужесточения контроля в сфере дистанционной продажи лекарств [3], развития параллельного импорта в нашей стране [6] и т.д.
Новизна исследования определена изучением современных тенденций в области развития таможенно-технического законодательства и практики борьбы с нелегальным обращением лекарственных препаратов с учетом последних изменений в области внешней торговли и модернизации средств внутринационального права зарубежных стран.
Методы исследования. В работе применены общенаучная методологияи познания юридических и социально-политических, рыночных отношений, категорий и явлений: анализ публикаций и диссертаций отдельных специалистов и аналитической количественной информации (с целью изучения современных рыночных процессов и практики оборота лекарственных препаратов и лечебных средств). Для обобщения полученного материала был произведен синтез результатов обсуждения и исследования отдельных проблемных вопросов для выработки предложений по совершенствованию российской политики в сфере фармакологии.
Инструменты конкретизации правовых явлений, категорий и процессов развития технического регулирования и таможенного законодательства отдельных зарубежных стран и России послужили вспомогательным специально-юридическим методом для выявления особенностей нормативного регулирования и закрепления мер и направлений борьбы с нелегальным обращением лекарственных средств (законодательных положений).
Формально-юридический метод использовался для исследования законодательства зарубежных стран в процессе анализа отдельных нормативных положений конкретных документов государств США, Китая, ЕС по таможенно-техническому регулированию в сфере реализации и производства фармакологических препаратов.
Метод сравнительного анализа использовался для выделения концептуальных положений законодательных актов, иных правительственных документов и мер изучаемых зарубежных стран с точки зрения сравнительной оценки позитивных достижений и опыта борьбы с негативными явлениями в области фармакологии и лечения заболеваний.
Контент-анализ как особый метод исследования заключался в изучении внутреннего содержания отдельных нормативных документов.
Противоправный и нелегальный оборот лекарственных препаратов, неофициальное обращение фальсифицированной и контрафактной продукции на фармацевтическом рынке представляется проблемой мирового значения и уровня, некондиционные и поддельные фармацевтические средства лечения и профилактики заболеваний распространены в отношении всех лекарств различных лечебных групп.
Также в мировом масштабе возникает проблема распространения дженериков как особых воспроизведенных неоригинальных лекарственных препаратов, требующих меньших затрат (в процессе снижения общих издержек) на создание и распространение, по сравнению с запатентованными, разработанными, прошедшими специальную проверку и брендовыми средствами медицины.
Например, в настоящее время по количеству в процентном отношении к оригинальным и прошедшим длительные клинические испытания препаратам в производстве дженериков лидируют довольно развитые западные зарубежные страны, такие как Австралия, Япония, США, Китай, Индия, государства ЕС, Великобритания (рисунок 1) [11; 13].
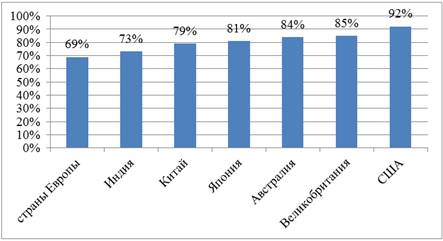
Рисунок 1. Доля неоригинальных (референтных) медицинских препаратов на рынке различных лекарств зарубежных стран (2023 год, в %)
Источник: составлено автором на основе [11; 13]
Более сложной и опасной проблемой представляется то, что нелицензионные, контрафактные, поддельные и некачественные фармакологические препараты, реализуемые на международном и национальном рынках, часто вызывают негативные эффекты при их приеме и/ или полностью не выполняют функции лечения. Этим они вызывают недоверие населения зарубежных стран в целом к сфере фармакологии и стандартного медикаментозного лечения.
По данным Всемирной организации здравоохранения (далее – ВОЗ) число обращений с 2014 года по вопросам нарушений в области нелегального обращения лекарственных препаратов (фальсифицированных или некондиционных) выросло с 1506 заявлений (жалоб) до 3156, зафиксированных до декабря 2023 года (т.е. более, чем в два раза, за последние 10 лет) (рис. 2) [7].
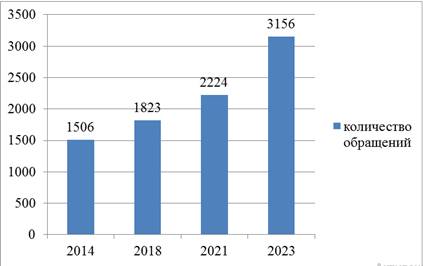
Рисунок 2. Динамика обращений по вопросам нарушений в области нелегального оборота лекарственных препаратов в ВОЗ (2014-2023 гг.)
Источник: [7]
При этом большая доля сообщений о нарушениях в сфере незаконного распространения лекарственных средств приходится на государства Африки (42 %), на зарубежные страны Европы и Америки приходится менее 20 % (рис.3) [7].
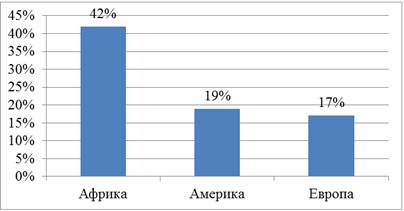
Рисунок 3. Соотношение количества обращений по вопросам нарушений в области нелегального оборота лекарственных препаратов в ВОЗ
Источник: [7]
Согласно различным экспертным оценкам российских специалистов (А.А. Таубэ, М.В. Федулова, С.Ю. Черников, и др.) [11-13], а также сотрудников и представителей ВОЗ ООН, доля продаваемых и производимых контрафактных, фальсифицированных фармакологических препаратов лекарственной группы в различных странах варьируется от 3 до 12 % [4]. При этом в развивающихся государствах данное соотношение превышает 15 % [13].
Поэтому довольно важным представляется изучение отдельных аспектов тарифно-таможенного и технического регулирования для борьбы с нелегальным обращением продукции и препаратов сферы фармакологии в зарубежных странах, учитывая, что более 75 % общего оборота лекарственных препаратов приходиться на такие государства, как Польша, Германия, США, Италия, Англия, Китай, Франция и другие [6].
В США для упорядочения оборота лекарственных препаратов и лечебных средств, а также борьбы незаконным и нелегальным обращением контрафактной, недоброкачественной, поддельной фармацевтической продукции поэтапно с 2013 года на современном этапе (вплоть до 2023 года) внедрялись действующие системы маркировки лекарств и показателей безопасности лекарственной продукции (законы Drug Quality and Security Act. (2013) и «О безопасности поставок лекарственных препаратов» (2013)) [5].
При этом в данной стране создан специализированный орган, осуществляющий контрольно-надзорные функции за безопасностью лекарственных препаратов и достижением максимально законного оборота фармацевтической продукции (FDA) в отношении проверок маркировки, эффективности, тестирования, испытания лечебных средств [9].
В области регламентации отношений по импорту и экспорту лекарственных препаратов США задействует значительный комплекс различных тарифных и нетарифных мер, которые в основном поддерживают исключительно интересы национальных производителей фармакологической продукции и безопасность внутреннего рынка лечебных средств.
Вся таможенная политика США направлена на стимулирование путем таможенных пошлин на ввоз продукции медицинской направленности высокого качества от проверенных брендовых производителей.
При ввозе в страну импортных лекарственных средств происходит сложная процедура, проводимая Таможенной службой государства, направленная на определение таможенного тарифа, исследования продукции фармакологии на соответствие техническим стандартам законодательства США, проверку соблюдения производителем лекарств законов об интеллектуальной собственности. При этом допускается к ввозу лишь та лекарственная продукция, которая имеет специально выданный на территории США экспортный сертификат и наименование страны-производителя на этикетке на английском языке [17].
В США довольно развита структура публично-частного партнерства в сфере технического регулирования оборота лекарственных препаратов и их стандартизации. На уровне власти принимаются лишь основы обязательных стандартов, базирующиеся на разработанных добровольных стандартах специальными аккредитованными организациями [7].
В США за реализацию и производство недоброкачественной и фальсифицированной фармацевтической продукции помимо различных административных штрафов, существует практика взимания убытков штрафного характера в доход публичных органов власти, которые порой достигают более 100 млн долларов и направлены на обеспечение неповторения нарушений в будущем. При этом должностные лица компетентных структур, занимающиеся сертификацией и стандартизацией, могут быть привлечены к ответственности даже за неосторожные действия (халатность и небрежность при проверке качества лекарств).
Данным опытом следует воспользоваться и при реформировании отечественного законодательства, направленного на борьбу с незаконным и нелегальным обращением на национальном рынке лекарственных препаратов. Ведь существующие меры уголовной и административной ответственности недостаточны на современном этапе. Хотя уже разработаны определенные законопроекты в области ужесточения и уточнения мер наказания, условий освобождения от ответственности и изменений диспозиции различных статей УК РФ (ст. 238.1) и КоАП РФ (ст. 6.33) за оборот фальсифицированных, контрафактных, недоброкачественных и незарегистрированных фармацевтических препаратов (законопроект № 103499-8 и № 103500-8) [10].
В странах Америки (Чили, Мексики, США) существуют, согласно исследованиям различных ученых и специалистов, различные проблемы, связанные: с незаконностью продаж лечебных средств в виде каннабиса подросткам [18]; негативным влиянием деятельности FDA на продвижение инноваций и появление новых фирм в фармакологии [17]; применением некачественной лекарственной продукции для лечения осужденных, находящихся в исправительных учреждениях [14]; нарушением порядка распространения отдельных лекарственных средств в Чили и Мексике [15; 16].
В ЕС Регламентом № 765/2008 (Regulation EC 765/2008) конкретизированы и регламентированы юридические рамки относительно выхода на европейский рынок различной лекарственной продукции и обязательства национальных органов таможни относительно их соблюдения, Директивой 2001/95/EC Европейского Парламента определяются основы безопасности фармацевтических препаратов, Директивой 2001/83/EC закреплены основы лицензирования импорта лекарственных средств [11].
При этом все страны Европы самостоятельны в установлении административных и уголовных санкций за реализацию и ввоз недоброкачественной, фальсифицированной и поддельной продукции медицинского и лечебного назначения.
Средства маркировки были приняты Директивой ЕС 2011/62/EU, а с 9 февраля 2019 года вступила в силу Директива 2011/62/EU «О фальсифицированных лекарствах (ящур)», которой вводится в обязательном порядке уникальный идентификатор в отношении различных лекарственных препаратов [7; 9].
При этом в Европе уникальный идентификатор лекарственного средства присваивается самим производителем, в отличие от российской публичной системы присвоения идентификатора.
В различных странах Европы довольно развит параллельный импорт иностранной фармакологической продукции.
В России необходимо рассмотреть все европейские стандарты с целью сближения мер национального таможенно-технического регулирования в области оборота лекарственных препаратов для проведения эффективной политики противодействия распространения фальсифицированной и поддельной продукции медицинского и лечебного назначения.
Различные аспекты стандартизации, технического регулирования и оборота лекарственных препаратов уже изложены в основных законах «О техническом регулировании» от 27.12.2002 № 184-ФЗ [1] и «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ [2]. Однако все законодательство, согласно возрастанию Интернет-торговли лекарственными средствами [3] и легализации параллельного импорта иностранной фармакологической продукции в России [6], должно быть модернизировано в ближайшем будущем.
В Китае же производство и распространение лекарственных препаратов подчиняется централизованному, полностью императивному публичному порядку регулирования и государственного планирования, а осуществление контрольно-надзорной деятельности полностью регламентировано законодательно (Drug Administration Law). Причем в закон об обороте лекарственных препаратов систематические вносятся изменения, в связи с ростом и распространением нелегального обращения фармакологической продукции.
Система контроля в КНР затрагивает все этапы производства, продажи, покупки, маркировки, сертификации, подтверждения соответствия, оценки качества, лицензирования лекарственной продукции. При этом в Китае действует более 10 ведомств, занимающихся в той или иной мере надзорно-контрольной деятельностью в сфере фармацевтической промышленности и импорта, экспорта лекарственных средств [7].
В целом, обзор и анализ различных публикаций, показателей распространенности поддельной и некачественной продукции сферы фармацевтики, опыт борьбы зарубежных стран с противозаконным оборотом лечебных средств доказывает, что вопрос технического и таможенного регулирования мер профилактики и предупреждения нелегального обращения недоброкачественных и фальсифицированных лекарственных средств требует постоянной доработки и является весьма распространенной тематикой для научных изысканий ученых, правоведов, специалистов всех стран.
ЗАКЛЮЧЕНИЕ
Анализ российских и зарубежных научных публикаций показал необходимость значительной доработки законодательной регламентации порядка противодействия нелегальному обращению фальсифицированной и поддельной продукции медицинского и лечебного назначения в России. А Отдельные достижения и опыт в области таможенно-технического регулирования оборота лекарственных (лечебных) средств в различных странах: США, Китае, странах Европейского Союза, иных зарубежных государствах, – могут послужить законодательной и практической основой для введения некоторых новых мер предупреждения и пресечения незаконного обращения фармацевтических препаратов.
Данная работа может быть полезна для дальнейшего изучения вопросов и направлений совершенствования всей таможенно-технической политики России в отношении развития импорта и экспорта лекарственных препаратов.
Источники:
2. Об обращении лекарственных средств: Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 19.10.2023). Консультант плюс. [Электронный ресурс]. URL: https://www.consultant.ru/document/cons_doc_LAW_99350/ (дата обращения: 10.01.2024).
3. Егорова А.В. Актуальные аспекты законодательства в отношении дистанционной продажи лекарственных препаратов на территории РФ // Современная организация лекарственного обеспечения. – 2021. – № 1. – c. 46-49. – doi: 10.30809/solo.1.2021.12.
4. Информационные бюллетени и данные ВОЗ, обобщенный анализ (2020-2023 гг.). Всемирная организация здравоохранения. [Электронный ресурс]. URL: https://www.who.int/ru/news-room/fact-sheets (дата обращения: 10.01.2024).
5. Мамедов Д.Д., Юрочкин Д.С., Лешкевич А.А., Эрдни-Гаряев С.Э., Голант З.М., Наркевич И.А. Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт североамериканского фармацевтического рынка // Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. – 2023. – № 16(1). – c. 80–86. – doi: 10.17749/2070-4909/farmakoekonomika.2022.155.
6. Нургалеев М. С., Петров Е. Н. Особенности правового регулирования параллельного импорта лекарственных средств в России // Юридическая наука. – 2019. – № 10. – c. 49-54.
7. Обзор лучших практик в сфере противодействия незаконному обороту промышленной продукции по группе товаров «Лекарственные средства». - Москва: ННЦК, 2022.
8. Тимченко Т. Н., Тонконог В. В., Погарская А. С. [и др.] Оборот лекарственных средств в Российской Федерации: таможенный аспект // Проблемы социальной гигиены, здравоохранения и истории медицины. – 2020. – c. 803-809. – doi: 10.32687/0869-866X-2020-28-s1-803-809.
9. Оценка достаточности и целесообразности обязательных требований, запретов, ограничений, оказывающих существенное влияние на объёмы легального производства и оборота промышленной продукции по группе товаров «лекарственные средства». - Москва: ННЦК, 2022.
10. Перечни законопроектов и проектов постановлений. Система обеспечения законодательной деятельности. [Электронный ресурс]. URL: https://sozd.duma.gov.ru/ (дата обращения: 22.01.2024).
11. Таубэ А. А. Некоторые аспекты нормативно-правового регулирования обращения лекарственных средств для медицинского применения в ЕС и ЕАЭС // Медико-фармацевтический журнал Пульс. – 2019. – № 10. – c. 12-19. – doi: 10.26787/nydha-2686-6838-2019-21-10-12-19.
12. Федулова М. В. Таможенное регулирование лекарственных средств на территории РФ // Международный журнал гуманитарных и естественных наук. – 2021. – № 1-3(52). – c. 168-170. – doi: 10.24411/2500-1000-2021-1154.
13. Черников С.Ю., Зобов А.М., Дегтерева Е.А. Ключевые проблемы организации контрактного производства иностранных лекарственных препаратов в развивающихся странах // Вестник Российского университета дружбы народов. Серия: Экономика. – 2023. – № 1. – c. 74-90. – doi: 10.22363/2313-2329-2023-31-1-74-90.
14. Apollonio D. Marketing Antipsychotics to Correctional Facilities: A Review of Pharmaceutical Industry Documents // Journal of Correctional Health Care. – 2022. – № 28(5). – p. 325-328.
15. Atal J., Cuesta J., González F., Otero C. The Economics of the Public Option: Evidence from Local Pharmaceutical Markets. - UC Berkeley: Center for Effective Global Action, 2021.
16. Lie-Spahn C. B. The Pharmocratics of Misoprostol: Race, Drugs, and Reproductive Neoliberalism. - UC Santa Cruz, 2019.
17. Rogers P. Regulating Health Care Markets: Impacts on Innovation, Market Structure, and Product Quality. - UC San Diego, 2023.
18. Shi Y., Pacula R. Assessment of Recreational Cannabis Dispensaries’ Compliance With Underage Access and Marketing Restrictions in California // JAMA Pediatrics. – 2021. – № 175(11). – p. 1178-1180.
Страница обновлена: 04.01.2026 в 09:19:19
Download PDF | Downloads: 22
Customs and technical regulation to combat illegal traffic of medicines in the far abroad
Kvyatkovskiy D.V., Zavyalov D.V.Journal paper
Journal of Economics, Entrepreneurship and Law
Volume 14, Number 3 (March 2024)
Abstract:
In this article, the peculiarities of customs and technical regulation of the turnover of medicines in various countries, such as the USA, China, the countries of the European Union, and other foreign countries, were revealed. Certain features and elements of the legal mechanism for combating illegal circulation of certain medicines were highlighted. Based on the analysis of various statistical indicators, negative aspects in the prevalence of counterfeit and falsified drugs on the market of pharmacological preparations have been identified.
This study of the issues of combating counterfeit and falsified products in the form of various illegally produced and released medicines is a completed research work with practical and scientific significance for various entities involved in the development and implementation of measures and means to counter illegal drug trafficking, as well as scientists and specialists in the field of customs and technical regulation, public administration, pharmacology, and law. The article also clarifies some problematic aspects of prevention and regulation of measures to combat illicit drug trafficking in foreign countries and Russia at the present stage, which determines the novelty of raising certain issues. The study of modern trends in the development of legal, organizational and technical means for the prevention and suppression of the illegal circulation of medicines makes it possible to acquire the publication character of a special applied research.
Keywords: technical regulation, legislation, foreign countries, medicines, pharmacological preparation, medicinal product, USA, China, European Union, illegal circulation
JEL-classification: L65, L81, O33
References:
Obzor luchshikh praktik v sfere protivodeystviya nezakonnomu oborotu promyshlennoy produktsii po gruppe tovarov «Lekarstvennye sredstva» [Review of the best practices in the field of combating illicit trafficking in industrial products for the group of products "Medicines"] (2022). Moskva : NNTsK. (in Russian).
Otsenka dostatochnosti i tselesoobraznosti obyazatelnyh trebovaniy, zapretov, ogranicheniy, okazyvayushchikh sushchestvennoe vliyanie na obyomy legalnogo proizvodstva i oborota promyshlennoy produktsii po gruppe tovarov «lekarstvennye sredstva» [Assessment of the sufficiency and expediency of mandatory requirements, prohibitions, restrictions that have a significant impact on the volume of legal production and turnover of industrial products in the group of goods "medicines"] (2022). Moskva : NNTsK. (in Russian).
Apollonio D. (2022). Marketing Antipsychotics to Correctional Facilities: A Review of Pharmaceutical Industry Documents Journal of Correctional Health Care. (28(5)). 325-328.
Atal J., Cuesta J., González F., Otero C. (2021). The Economics of the Public Option: Evidence from Local Pharmaceutical Markets UC Berkeley : Center for Effective Global Action.
Chernikov S.Yu., Zobov A.M., Degtereva E.A. (2023). Klyuchevye problemy organizatsii kontraktnogo proizvodstva inostrannyh lekarstvennyh preparatov v razvivayushchikhsya stranakh [Key problems of the foreign medicines contract production organization in developing countries]. Bulletin of the Russian University of Peoples\' Friendship. series: economics. 31 (1). 74-90. (in Russian). doi: 10.22363/2313-2329-2023-31-1-74-90.
Egorova A.V. (2021). Aktualnye aspekty zakonodatelstva v otnoshenii distantsionnoy prodazhi lekarstvennyh preparatov na territorii RF [Topical aspects of legislation regarding remote sale of medicines in the territory of the Russian Federation]. Sovremennaya organizatsiya lekarstvennogo obespecheniya. 8 (1). 46-49. (in Russian). doi: 10.30809/solo.1.2021.12.
Fedulova M. V. (2021). Tamozhennoe regulirovanie lekarstvennyh sredstv na territorii RF [Customs regulation of drugs on the territory of the Russian Federation]. International Journal of Humanities and Natural Sciences. (1-3(52)). 168-170. (in Russian). doi: 10.24411/2500-1000-2021-1154.
Lie-Spahn C. B. (2019). The Pharmocratics of Misoprostol: Race, Drugs, and Reproductive Neoliberalism
Mamedov D.D., Yurochkin D.S., Leshkevich A.A., Erdni-Garyaev S.E., Golant Z.M., Narkevich I.A. (2023). Normativnoe pravovoe regulirovanie izgotovleniya lekarstvennyh preparatov aptechnymi organizatsiyami: opyt severoamerikanskogo farmatsevticheskogo rynka [Compounding pharmacy regulations: experience of the north american pharmaceutical market]. Farmakoekonomika. Sovremennaya farmakoekonomika i farmakoepidemiologiya. (16(1)). 80–86. (in Russian). doi: 10.17749/2070-4909/farmakoekonomika.2022.155.
Nurgaleev M. S., Petrov E. N. (2019). Osobennosti pravovogo regulirovaniya parallelnogo importa lekarstvennyh sredstv v Rossii [Features of the legal regulation of parallel import of medicines in Russia]. Yuridicheskaya nauka. (10). 49-54. (in Russian).
Rogers P. (2023). Regulating Health Care Markets: Impacts on Innovation, Market Structure, and Product Quality
Shi Y., Pacula R. (2021). Assessment of Recreational Cannabis Dispensaries’ Compliance With Underage Access and Marketing Restrictions in California JAMA Pediatrics. (175(11)). 1178-1180.
Taube A. A. (2019). Nekotorye aspekty normativno-pravovogo regulirovaniya obrashcheniya lekarstvennyh sredstv dlya meditsinskogo primeneniya v ES i EAES [Some aspects of legal regulation of circulation of medicinal products for medical use in the EU and the EAEU]. Mediko-farmatsevticheskiy zhurnal Puls. 21 (10). 12-19. (in Russian). doi: 10.26787/nydha-2686-6838-2019-21-10-12-19.
Timchenko T. N., Tonkonog V. V., Pogarskaya A. S. [i dr.] (2020). Oborot lekarstvennyh sredstv v Rossiyskoy Federatsii: tamozhennyy aspekt [Drug turnover in the Russian Federation: customs aspect]. Problemy sotsialnoy gigieny, zdravookhraneniya i istorii meditsiny. 28 803-809. (in Russian). doi: 10.32687/0869-866X-2020-28-s1-803-809.
