Хирургическое лечение и таргетная терапия рака – организационные и социально-экономические аспекты
Юрова Е.Н.1, Голышко П.В.2, Сертакова А.В.3
1 Министерство здравоохранения Московской области, Россия, Москва
2 ГБУЗ ГКБ им. Д.Д. Плетнёва ДЗМ, ,
3 ГБУЗ МКНЦ им. А.С. Логинова ДЗМ, ,
Скачать PDF | Загрузок: 35
Статья в журнале
Экономика и социум: современные модели развития (РИНЦ)
опубликовать статью
Том 11, Номер 4 (Октябрь-декабрь 2021)
Эта статья проиндексирована РИНЦ, см. https://elibrary.ru/item.asp?id=48444598
Аннотация:
В статье изложены основные аспекты, связанные с организацией онкологической помощи российскому населению. Описаны некоторые социальные и экономические проблемы, которые не позволяют повсеместно использовать научные достижения (высокотехнологичная хирургия и таргетная терапия) для лечения злокачественных новообразований. Статистические данные демонстрируют прямую зависимость между организационной, социально-экономической эффективностью онкологической помощи и вероятностью смерти пациентов от рака. Показано, что непрерывность процесса (от профилактики и скрининга до лечения и реабилитации), технологичность и лекарственная прогрессивность онкологической помощи значимо снижают риски онкологической заболеваемости и смертности.
Ключевые слова: онкология, таргетная терапия, социально-экономическая эффективность, хирургия, технологии, заболеваемость, смертность
Введение. В России смерть от онкологического заболевания – вторая по значимости причина, вносящая свой весомый вклад в общую динамику и структуру смертности населения. В среднем вероятность летального исхода в результате онкологического заболевания в России составляет около 49%, при этом у мужчин вероятность смерти от рака примерно в 1,5-2 раза выше, чем у женщин.
По данным последних лет ежегодные общие расходы Фонда обязательного медицинского страхования на онкологическую помощь населению превысили 200 млрд рублей [4], к этой сумме следует прибавить еще, как минимум, столько же – многие пациенты онкологического профиля стремятся получить лечение за границей или в коммерческих медицинских организациях.
Вместе с тем российская клиническая онкология накопила достаточный научный и практический опыт, необходимый для организационного совершенствования онкологической помощи населению, а также для повышения её социальной и экономической эффективности. Не исключение в этом смысле и хирургическое лечение онкологических заболеваний, которое в настоящее время за рубежом дополняется не традиционной химиолучевой терапией, но таргетной терапией, которая основана на нахождении мишеней в раковых опухолях, отвечающих на препарат конкретного действия. Это позволяет воздействовать на опухоль прицельно, не задевая при этом здоровые клетки и ткани.
В статье будут рассмотрены основные этапы становления онкологической помощи населению в России, а также будет представлено обоснование необходимости организационного совершенствования такой помощи в целях повышения её социальной и экономической эффективности, в том числе с использованием таргетной терапии.
Основные результаты. По итогам 2020 года в мире было зарегистрировано не менее 10 млн смертей от рака [1]. Эксперты ВОЗ ожидают, что данные статистики за 2021 год будут ещё более удручающими [2], поскольку пандемия критически нарушила логистику и организацию процесса профилактики, скрининга (раннего выявления), лечения и реабилитацию пациентов со злокачественными новообразованиями.
В России показатель количества смертей от новообразований составил на начало 2021 года 295,9 тыс. человек, и этот показатель почти не изменился за последние 40 лет (рис. 1).
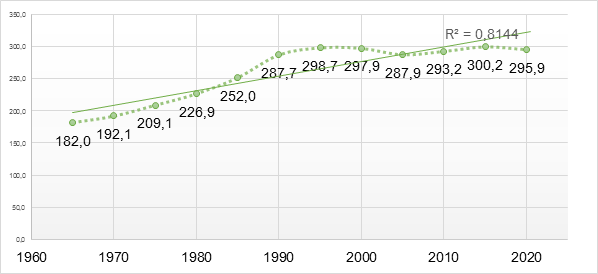
Рис. 1. Динамика количества смертей от новообразований в России [5]
Но доля умерших от новообразований в общем количестве смертей в России устойчиво снижалась в период с 1965 по 2005 год включительно, далее опять наблюдался прирост доли смертности от рака (рис. 2).
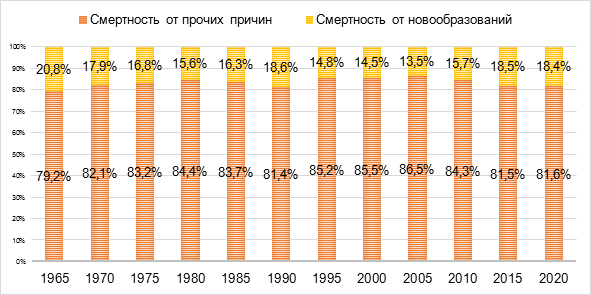
Рис. 2. Динамика доли смертности от новообразований среди общего количества зарегистрированных смертей в России [5]
Вероятно, на ближайшие несколько лет доля смертей от злокачественных новообразований в России установится на уровне 18-20%, а общее количество смертей от различных типов и видов рака будет варьировать в диапазоне от 300 до 320 тыс. человек в год. И это очень высокие показатели, поскольку история клинической онкологии в России насчитывает более 120 лет.
Первый раковый институт был открыт в 1898 году в Москве (ныне это Онкологический институт имени Герцена). В 1904 году в Санкт-Петербурге создается Общество по порьбе с раком, а в 1911 году открывается первая больница для бедных женщин, больных раком. Развивается и научно-методическое сопровождение – издаются руководства по онкологии, проводятся научные симпозиумы и конгрессы. Безусловно, Первая и Вторая мировые войны негативно повлияли на динамику развития клинической онкологии в России, а также на её хирургическое и медикаментозное сопровождение. Но в 1945 году была вновь воссоздана самостоятельная служба онкологической помощи населению, которая, конечно же, к настоящему моменту прошла через несколько организационных и институциональных реформ [3].
При этом первым методическим подходом к лечению злокачественных новообразований был хирургический подход – иссечение опухоли из органов и тканей. Следует отметить, что самые первые попытки хирургического лечения опухолей предпринимались ещё в Античности. Далее, в связи с открытием физиками различных видов излучений, на стыке XIX и XX века появляется ещё один метод лечения злокачественных новообразований, который служит дополнением к оперативному вмешательству, – лучевая терапия. Между Первой и Второй мировыми войнами были разработаны принципы и препараты для химиотерапии (цитотоксической и цитостатической).
Необходимость разработки новых методов лечения была связана с тем, что оперативное вмешательство позволяет иссечь саму опухоль, но не метастазы, которые она даёт. Именно от метастазирования умирают онкологические больные.
Таким образом к середине прошлого века с научно-методической точки зрения лечение онкологических заболеваний основывается на триаде методов: хирургия, лучевая терапия, химиотерапия. Достижения и открытия в области молекулярной онкологии в конце прошлого века позволили предложить новую концепцию химиотерапии, основанную на нахождении мишеней в раковых клетках, на которые целенаправленно действует лекарственное средство [10].
Это был ещё один шаг в лечении онкологических заболеваний, который позволил точно и прицельно работать на устранение метастазных клеток, которые даёт опухоль. Таргетная терапия представлена в настоящее время двумя типами или классами химических веществ – вещества с малой молекулярной массой (малые молекулы) и моноклональные антитела. Логическим продолжением таргетной терапии является иммунная терапия. Если таргетная терапия прицельно работает на уничтожение раковых клеток по всему организму, но иммунная терапия, напротив, стимулирует иммунную систему больного, соответственно организм пациента самостоятельно борется со злокачественным новообразованием.
Иммунотерапия рака – это новое перспективное направление лекарственного лечения злокачественных новообразований с использованием модифицированных иммунотерапевтических антител [7]. Такое лечение не следует путать с так называемыми иммуностимуляторами растительного или химического происхождения, которые рекламируются в СМИ, но не имеют клинических доказательств эффективности.
Итак, к настоящему моменту мы можем заключить, что рак в различных его проявлениях – это социально значимое заболевание, которое требует специальных методов лечения, которые обычно используются в комплексе, т.е. оперативное вмешательство, лучевая терапия и химиотерапия традиционная или таргетная, а также иммунотерапия. В некоторых случаях оперативное вмешательство невозможно (опухоль неоперабельная по тем или иным причинам) и тогда используется консервативное лечение (лучевая, химио-, иммунотерапия). Стоимость лечения онкологических заболеваний зависит от различных факторов, но основными здесь являются следующие:
1) возраст и общее состояние здоровья онкологического пациента, наличие у него вредных привычек, избыточного веса, профессиональных или иных хронических заболеваний;
2) избираемый план лечения в рамках прогноза течения заболевания – общий или персонализированный, а также основные методы, включаемые в план лечения – обычное или высокотехнологичное оперативное вмешательство, использование лучевой, традиционной или таргетной химиотерапии, иммунотерапии и продолжительность консервативного вмешательства;
3) организация ухода, паллиативной помощи, включение в план лечения реабилитационных практик (физическая терапия, психотерапия, ресоциализация после получения инвалидности т.п.);
4) тип медицинской организации – бюджетная или коммерческая и способ возмещения затрат на лечение (страхование или за счёт собственных средств пациента).
Поэтому стоимость одного дня лечения онкологического пациента в условиях стационара может составлять от 20-25 тыс. до 500 тысяч рублей и более. И хотя в России почти все граждане имеют полис ОМС это не даёт гарантии получения современной высокотехнологичной и лекарственно прогрессивной онкологической помощи. Как правило, в мегаполисах и региональных центрах онкологические пациенты могут надеяться на получение качественной медицинской помощи.
Напротив, в средних и малых городах, а также в сельских поселениях населению недоступна онкологическая помощь, тем более недоступны новые методы лечения, такие как:
а) роботизированные прецизионные и малоинвазивные оперативные вмешательства;
б) таргетная терапия с использованием лекарственных средств на основе малых молекул или моноклональных антител;
в) иммунотерапия: клеточная, цитокиновая, комбинированная.
Также следует отметить, что у онкологических больных в мегаполисах и региональных центрах больше возможностей для получения надлежащего ухода, паллиативной помощи, реабилитации. Это возможно в том числе за счёт работы благотворительных фондов и некоммерческих организаций.
Общеизвестно, что надлежащий уход и прочие виды немедицинской помощи онкологическим пациентам обеспечивают приверженность последнего к лечению, соблюдению всех рекомендаций, тем самым благоприятный исход для таких пациентов (полная ремиссия и ресоциализация) получает больше вероятности реализации [6], нежели неблагоприятный (при условии, что опухоль не является агрессивной, её "поведение" относительно предсказуемо).
В странах объединенной Европы, Северной Америки и развитых азиатских странах организационные и социально-экономические аспекты онкологической помощи имеют лучшие, по сравнению с российскими, характеристики. Так, например, в развитых странах происходит повсеместный переход на высокотехнологичную хирургию, таргетную и иммунную терапию в лечении различных типов и видов рака.
Такой подход, во-первых, является менее травматичным для пациента, его органов и тканей, во-вторых, несёт в себе значительно меньше токсических эффектов, которые обычно случаются в традиционной химиотерапии и лучевой терапии. В-третьих, переход на высокие технологии в хирургии рака и медикаментозном его лечении увеличивает: общую выживаемость пациентов, выживаемость без прогрессирования опухоли за счет более высокой частоты ответов опухоли на лечение.
Лидером в области своевременного выявления и эффективного лечения онкологических заболеваний являются США, где в среднем на 2 млн ежегодно вновь выявляемых случаев рака приходится не более 610 тыс. смертей, соответственно вероятность смерти в данном случае 26,8% (рис. 3).
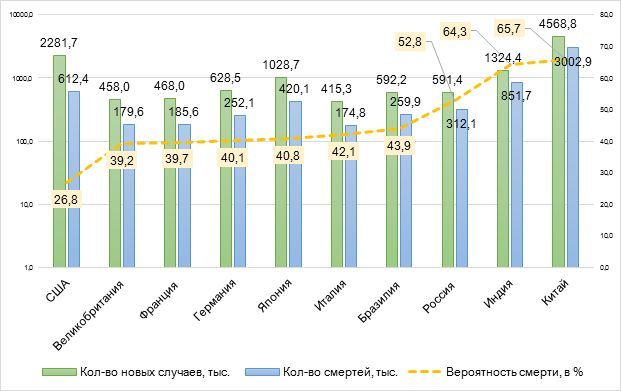
Рис. 3. Данные о новых случаях и смертях от онкологических заболеваний в некоторых странах по состоянию на начало 2022 года [8]
За США следуют Великобритания, Франция, Германия, Япония – в этих странах вероятность смерти от онкологического заболевания составляет от 39% до 40%. Несколько хуже показатели Италии и Бразилии – здесь национальные системы здравоохранения не такие развитые, как в выше указанных странах, поэтому вероятность смерти от рака в Италии и Бразилии составляет около 42-44%. В России, Индии и Китае вероятность смерти ещё выше – соответственно, 53%, 64% и 66% от всех вновь выявленных случаев.
В США, Великобритании, Франции, Германии, Японии далеко не одни и те же условия обеспечивают лучшую онкологическую практику и значительно более высокую выживаемость пациентов со злокачественными опухолями. В США, как уже было сказано выше, это преимущественно: развитая система здравоохранения, распространенные программы скрининга и профилактики (например, прививки от вируса папилломы человека внесены в национальный календарь прививок), высокотехнологичная хирургия и прогрессивное медикаментозное обеспечение онкологической помощи населению.
В Великобритании, Франции и Германии также хорошо развиты национальные системы здравоохранения, но уровень технологичности хирургического лечения злокачественных новообразований не везде такой же высокий, как в США. Однако медикаментозное обеспечение клинической онкологии в большинстве случаев прогрессивное, а программы скрининга и профилактики такие же действенные, как в США. В Японии ситуация с онкологической помощью населению примерно такая же как в Великобритании, Франции и Германии и в некоторых случаях по технологичности превосходит США, но одновременно с этим многие японские граждане, занятые в экономике, находятся в состоянии дистресса – постоянного негативного стресса из-за национальных особенностей организации труда и социально-трудовых отношений, что выражается в том числе в избыточном потреблении алкогольных напитков. При этом общеизвестно, что некоторые типы и виды рака можно отнести к стресс-ассоциированным заболеваниям, вредные привычки – это первый фактор риска развития злокачественного новообразования у человека.
Россия, Индия и Китай – это страны с объективно плохо развитыми национальными системами здравоохранения. Кроме этого, в Индии до сих пор значительная часть населения живет либо за чертой, либо возле черты бедности, а программы скрининга и профилактики рака практически не работают.
В России и Китае уровень жизни населения выше, чем в Индии, но организация онкологической помощи с точки зрения технологичности и медикаментозного обеспечения не может быть признана эффективной, а программы скрининга и профилактики представлены фрагментарно. В среднем аналогичная ситуация в Бразилии, частично это же справедливо для Италии.
При этом в Италии, как и в других странах Европейского Союза, прогрессивное медикаментозное обеспечение онкологической помощи не является дефицитным, однако смертность от рака на уровне развивающихся стран. Это связано в том числе с распространённостью вредных привычек (выше, чем в других странах Европейского Союза), а также с некоторыми национальными особенностями поведения итальянских граждан, что сказывается на дисциплине пациентов и их приверженности лечению.
Кроме этого следует признать, что представленные в странах Европейского Союза и в США программы профилактики рака и скрининга некоторых онкологических заболеваний позволяют сократить вероятность смерти [4, 9]:
а) в среднем на 70-90% от рака шейки матки за счет вакцинации от вируса папилломы человека и периодических цитологических обследований женщин в возрасте старше 35-40 лет;
б) в среднем на 20% от рака молочной железы за счёт периодически проводимых обследований (маммография) женщин в возрасте старше 45-50 лет;
в) в среднем на 40-60% от рака прямой и толстой кишки за счёт периодически проводимых обследований (колоноскопия и тест на скрытую кровь) всего населения в рамках диспансерных наблюдений;
г) в среднем на 20% от рака лёгкого за счёт периодически проводимых обследований (низкодозовая компьютерная томография) всего населения в рамках диспансерных наблюдений.
Всё вышесказанное о сокращении смертности от онкологических заболеваний справедливо и для России. Таким образом, хирургическое лечение, таргетная и иммунная терапия различных типов и видов рака в России может стать организационно, социально и экономически эффективной, но для этого, во-первых, необходимо институциональное реформирование национального здравоохранения, во-вторых, построение непрерывного процесса (от профилактики и скрининга, до лечения и последующей реабилитации) предоставления онкологической помощи всем гражданам.
Заключение. В данной статье представлен обзор эволюции развития онкологической помощи в России, а также представлены данные онкологической статистики как по Российской Федерации, так и по некоторым другим странам. В статье показано, что российская онкологическая практика уже имеет достаточно опыта в области использования высокотехнологичной хирургии и прогрессивного медикаментозного лечения злокачественных новообразований. Однако этот опыт в основном сконцентрирован в центрах экономического притяжения – городах-мегаполисах и некоторых региональных столицах. В провинции такая эффективная онкологическая помощь либо является малодоступной, либо является недоступной вообще.
Но опыт мировой клинической онкологии показывает, что социально значимое заболевание – рак – может и должен быть излеченным, тем более что необходимые для этого методики и способы уже разработаны (роботизированная, а, значит, прецизионная и малоинвазивная хирургия, таргетная терапия, иммунотерапия) и в развитых странах доступны практически всем категориям населения. Передовые позиции в этом вопросе занимают США, далее следуют страны Западной и Северной Европы. Россия, вместе с Индией и Китаем, занимает аутсайдерское положение в области профилактики, скрининга, лечения и реабилитации пациентов со злокачественными новообразованиями. Поэтому вероятность смерти от онкологического заболевания в России превышает 50%, в Индии и Китае этот показатель превышает 60%.
Представленные в статье материалы ещё раз подтверждают необходимость проведения организационных и институциональных реформ в российской системе здравоохранения с тем, чтобы повысить и социальную, и экономическую эффективность лечения онкологических заболеваний с использованием высокотехнологичной хирургии, прогрессивной медикаментозной терапии.
Источники:
2. Осама А.М., Мун Д.В., Фатма Д. Ответные меры на пандемию COVID-19: экономика и здравоохранение экономически развитых и развивающихся стран // Экономические отношения. – 2020. – № 4. – c. 981-998. – doi: 10.18334/eo.10.4.111083.
3. Девличарова Р.Ю., Засыпкина Е.В. История развития онкологической службы в России // Бюллетень медицинских интернет-конференций. – 2017. – № 3. – c. 638-639.
4. Тюляндин С.А., Жуков Н.В. Правда о российской онкологии: проблемы и возможные решения. - М.: Общероссийская общественная организация «Российское общество клинической онкологии», 2018. – 28 c.
5. Демография. Росстат. [Электронный ресурс]. URL: https://rosstat.gov.ru/folder/12781 (дата обращения: 10.01.2022).
6. Booth C.M., Karim S., Mackillop W.J. Real-world data: towards achieving the achievable in cancer care // Nature Reviews Clinical Oncology. – 2019. – № 5. – p. 312-325. – doi: 10.1038/s41571-019-0167-7.
7. Hegde P.S., Chen D.S. Top 10 challenges in cancer immunotherapy // Immunity. – 2020. – № 1. – p. 17-35. – doi: 10.1016/j.immuni.2019.12.011.
8. Cancer Today. International Agency for Research of Cancer. [Электронный ресурс]. URL: https://gco.iarc.fr/today/home (дата обращения: 10.01.2022).
9. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020 // Ca : a Cancer Journal for Clinicians. – 2020. – № 1. – p. 7-30. – doi: 10.3322/caac.21590.
10. Wu H.C., Chang D.K., Huang C.T. Targeted therapy for cancer // Journal of Cancer Molecules. – 2006. – № 2. – p. 57-66.
Страница обновлена: 15.12.2025 в 18:08:45
Download PDF | Downloads: 35
Surgical treatment and targeted cancer therapy: organizational and socio-economic aspects
Yurova E.N., Golyshko P.V., Sertakova A.V.Journal paper
Economics and society: contemporary models of development
Volume 11, Number 4 (October-December 2021)
Abstract:
The article outlines aspects related to the organization of oncological care for the Russian population.
Some social and economic problems that do not allow the widespread use of scientific achievements in the field of high-tech surgery and targeted therapy for the treatment of malignant neoplasms are described. Statistics demonstrate a direct relationship between the organizational and socio-economic efficiency of cancer care and the likelihood of patients' deaths from cancer. It has been shown that the continuity of the process (from prevention and screening to treatment and rehabilitation), manufacturability and drug progressivity of cancer care significantly reduce the risks of cancer morbidity and mortality.
Keywords: oncology, targeted therapy, socio-economic efficiency, surgery, technology, morbidity, mortality
References:
Booth C.M., Karim S., Mackillop W.J. (2019). Real-world data: towards achieving the achievable in cancer care Nature Reviews Clinical Oncology. 16 (5). 312-325. doi: 10.1038/s41571-019-0167-7 .
Cancer TodayInternational Agency for Research of Cancer. Retrieved January 10, 2022, from https://gco.iarc.fr/today/home
Devlicharova R.Yu., Zasypkina E.V. (2017). Istoriya razvitiya onkologicheskoy sluzhby v Rossii [History of oncological service in Russia]. Bulletin of medical internet conferences (Bûlleten’ medicinskih internet-konferencij). 7 (3). 638-639. (in Russian).
Hegde P.S., Chen D.S. (2020). Top 10 challenges in cancer immunotherapy Immunity. 52 (1). 17-35. doi: 10.1016/j.immuni.2019.12.011.
Osama A.M., Mun D.V., Fatma D. (2020). Otvetnye mery na pandemiyu COVID-19: ekonomika i zdravookhranenie ekonomicheski razvityh i razvivayushchikhsya stran [Responding to the COVID-19 pandemic: economics and health of economically developed and developing countries]. Journal of International Economic Affairs. 10 (4). 981-998. (in Russian). doi: 10.18334/eo.10.4.111083.
Siegel R.L., Miller K.D., Jemal A. (2020). Cancer statistics, 2020 CA: a cancer journal for clinicians. 70 (1). 7-30. doi: 10.3322/caac.21590.
Tyulyandin S.A., Zhukov N.V. (2018). Pravda o rossiyskoy onkologii: problemy i vozmozhnye resheniya [The truth about Russian oncology: problems and possible solutions] M.: Obshcherossiyskaya obshchestvennaya organizatsiya «Rossiyskoe obshchestvo klinicheskoy onkologii». (in Russian).
Wu H.C., Chang D.K., Huang C.T. (2006). Targeted therapy for cancer Ournal of Cancer Molecules. 2 (2). 57-66.
